※スクロールしてご確認ください
| 研究組織名 | 慶應義塾大学 生体防御薬学研究センター |
|---|---|
| 研究プロジェクト名 | 細胞内シグナル分子と薬物との相互作用の解析ならびにシグナル分子を標的とする難治性の疾患治療薬の開発 |
| 研究代表者 | 教授:笠原 忠 |
| 研究期間 | 平成16~20年度 |
| プロジェクト 参加研究者数 |
18名 |
プロジェクトに参加する主な研究者
サブテーマ1:シグナル分子を標的とする疾患治療薬の設計と開発
(グループリーダー:増野 匡彦)
※スクロールしてご確認ください
| 研究者名 | 職名 | プロジェクトでの研究課題 | プロジェクトでの役割 |
|---|---|---|---|
| 増野 匡彦 | 教授 | 難治性疾患治療薬を目指したフラーレン誘導体の開発 | フラーレン誘導体などの設計と合成 |
| 中村 成夫 | 准教授 | 受容体との相互作用、細胞内レドックス制御に基づく難治性の疾患治療薬を目指した天然物の探索 | 同上 |
| 竹田 忠紘 | 教授 | 細胞間認識現象を標的とした糖脂質の開発 | 薬用植物からの制御分子の探索 |
| 羽田 紀康 | 准教授 | 同上 | 糖脂質の探索と合成 |
| 須貝 威 | 教授 | アポトーシスを標的とした抗がん剤リード化合物の開発および関連物質合成の基礎的検討 |
サブテーマ2:細胞内シグナル伝達分子との薬物薬物との相互作用の解析
(グループリーダー:田村 悦臣)
※スクロールしてご確認ください
| 研究者名 | 職名 | プロジェクトでの研究課題 | プロジェクトでの役割 |
|---|---|---|---|
| 笠原 忠 | 教授 | アレルギー炎症とサイトカインシグナル系の解析 | 研究代表者:研究企画と統括サイトカインシグナルの解析 |
| 園田 よし子 | 教授 | アポトーシスと抗アポトーシスシグナル系の解析 | アポトーシスシグナルの解析 |
| 竹鼻 眞 | 教授 | 白内障発症要因分子の解析と発症予防薬の探索 | 白内障発症要因の解析 |
| 田村 悦臣 | 教授 | 神経ステロイド硫酸抱合反応とアルツハイマー病との相関性の解析 | グループリーダー:難治性神経疾患の創薬の検討 |
| 杉本 芳一 | 教授 | 薬物排出トランスポーターとシグナル伝達阻害剤の相互作用の解析 | SNPs解析、トランスポーターの解析 |
| 野口 耕司 | 准教授 | 同上 | 同上 |
サブテーマ3:シグナル伝達制御を基盤とした薬物療法の最適化研究
(グループリーダー:中島 恵美)
※スクロールしてご確認ください
| 研究者名 | 職名 | プロジェクトでの研究課題 | プロジェクトでの役割 |
|---|---|---|---|
| 三澤 日出巳 | 教授 | 免疫細胞におけるアセチルコリン受容体の機能解析 | コリン作動系の役割解析 |
| 中島 恵美 | 教授 | 血管新生と脈管・組織関門形成のシグナル伝達制御 | 血管新生抑制と新生に関わるシグナル分子薬剤の開発 |
| 崔 吉道 | 准教授 | 同上 | 同上 |
| 柴崎 敏昭 | 教授 | シグナル分子を標的とする難治性糖尿病性腎症への新規治療薬の有効性と安全性の評価 | 難治性疾患の病態解明と新規治療薬の有効性、安全性評価 |
| 細山田 真 | 准教授 | 同上 | 同上 |
| 金澤 秀子 | 教授 | シグナル伝達調節因子の標的化・安定化のための薬物送達システムの構築 | シグナル分子標的薬物送達システムの開発アッセイシステムの構築 |
| 服部 豊 | 教授 | 新たな炎症マーカー開発のためのα1アンチキモトリプシンの翻訳後修飾解析 | |
| 飯島 史朗 | 講師 | 同上 | 生体高分子解析機器類の管理運営とデータ解析 |
プロジェクトでの研究課題
サブテーマ1:シグナル分子を標的とする疾患治療薬の設計と開発
グループリーダー 増野 匡彦
(1)研究プロジェクトの目的・意義及び計画の概要
【目的・意義】
現在、受容体拮抗薬、増殖阻害薬、キナーゼ阻害薬、転写因子阻害剤など、細胞内シグナル伝達に関わる疾患治療薬が多数あるが、それらは特異性や副作用など問題も多く、より選択的で有効な薬物の開発が望まれている。サブテーマ1では従来の医薬品とは異なったユニークな生理活性物質の設計と合成、天然物からの探索を行い、その生理活性をもとに生体内でターゲットとなるシグナル分子の予測を行い、それらへの相互作用を解明していく。後半のシグナル分子関連の検討はサブテーマ2と共同して遂行する。細胞内シグナル分子と生理活性物質との相互作用を明らかにすることによりシグナル分子を標的とした難治性の疾患に対するより選択性の高い優れた治療薬の開発を展開することをめざす。
【計画の概要】
サブテーマ1では有効で、安全性の高い難治性疾患薬開発へのアプローチとして、従来の医薬品とは骨格から異なる生理活性物質の新規化合物の設計と合成、または天然物からの探索が有効と考えた。はじめに様々なターゲットを設定し、従来の医薬品と異なるユニークで幅の広いリード化合物候補のライブラリーを創製する。具体的には、制がん効果を目指したクロスリンク剤、フラーレン誘導体、肝機能障害や免疫調整に関与する糖脂質、細胞内レドックス制御に関連する化合物の設計と合成を行う。天然物からは制がん化合物、オピオイド受容体作動薬、細胞内レドックス制御に関連する化合物の分離、精製を行う。その生理活性に関する知見をもとにターゲット分子の特定と相互作用の解明をサブテーマ2と共同で行う。相互作用に関する知見をもとに、さらに有効な化合物の設計と合成を行い、最適化を進める。
(4)研究プロジェクトの進捗状況・研究成果等
【スケジュールに照らした各年度ごとの進捗状況及び達成度】
1年目
制がん効果を目指した新規化合物や免疫調整に関与する糖クラスターの設計と合成、オピオイド受容体作動薬などを目指した植物成分の分離、精製と同定を行った。
- 制がん効果を目指した新規化合物 芳香環を有するクロスリンク剤としてbis(bromomethyl)quinoline類(BBMQ)について、既に開発している正常p53遺伝子を有するヒト白血病由来細胞CCRF-HSB-2を用いた抗がん性スクリーニングシステムを用いて抗腫瘍活性を検定した。BBMQ処理によりCCRF-HSB-2細胞において速やかなp53タンパク質誘導とそれに伴ったアポトーシスを確認した。さらにp21の発現の増加とこれに伴った細胞周期の停止も観察した。また、フラーレン誘導体1ががん細胞増殖抑制効果、抗菌活性など幅広い生理活性を示すことから、正電荷をもつことが生理活性発現に必要と考え、2~4のスルホニウム型フラーレンをデザインした。構造的により1に近い3、4は、対応するテトラヒドロチオフェン誘導体をフルオロスルホン酸メチルによりメチル化することにより合成した。

- 免疫調整に関与する糖クラスター エキノコックス由来糖脂質(5~8)は、エキノコックス症の患者血清と相関があり、抗原性を持つことからこれらを合成し、合成化合物における抗原性を調べた。その結果、4種類の化合物ともに患者血清と相関があり、特にフコースを含有する化合物6及び8と強く反応する血清があり、患者血清にはGalβ1-6Galを認識する血清と、Fucα1-3を強く認識する血清の二種類あることが判明した。

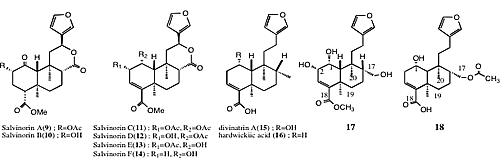
- オピオイド受容体作動薬を目指した植物成分の分離、精製と同定 オピオイドκ受容体アゴニストとして作用するジテルペノイド成分を含有するメキシコ原産のシソ科植物Salvia divinorumの成分精査を行い、化合物9-18を得た。化合物17, 18は新規化合物である。Salvinorin A (1)はκ受容体に対する選択性が高いことが報告されており、これらのジテルペノイドの探索はオピオイド受容体の機能解明やκ受容体の関与が示唆されている中枢性の痒みに対する治療薬の開発につながるものと考えられる。
2年目
細胞内レドックス制御活性を有する新規化合物の設計と合成、制がん効果などを有する天然物の探索、さらに前年度から引き続き免疫調整に関与する糖クラスターの合成やオピオイド受容体作動薬を目指した天然物の探索を行った。
- 細胞内レドックス制御活性を有する新規化合物 アスコルビン酸と同様に電子求引基と共役したエンジオール構造を有する2,2'-pyridoin(α-pyridoin,19)類の抗酸化活性の検討を展開した。19の誘導体20-25を合成し、活性を検討したところ、23と25がアスコルビン酸よりも優れた抗酸化活性を有しかつプロオキシダント効果の少ない可能性を見出した。そこで、ピリジン環をチオフェン環に置換した化合物、2,2'-thenoin(26)の抗酸化活性に注目したところ19より弱いながらも抗酸化活性を有し、プロオキシダント効果がより低いことも示唆された。さらに2,2'-thenoinをリードとして種々の誘導体を合成したところ、Brを導入した28が26よりも高い活性を示し、電子求引基により活性が増大することが示された。

- 制がん効果やオピオイド受容体作動薬を目指した天然物の探索観葉植物として知られるユリ科植物のオリヅルラン(Chlorophytum comosum)の根茎抽出物について、CCRF-HSB-2を用いた抗がん性スクリーニングシステムを用いて抗腫瘍活性を検定した。オリヅルランの根茎部分を凍結状態ですり下ろし、固形物を取り除いてから遠心分離した。得られた褐色の上清をヘキサン、クロロホルム、酢酸エチル、ブタノールで順次抽出し、溶媒を減圧留去して残渣を得た。各残渣についてCCRF-HSB-2細胞の応答を調べたところ、ブタノール抽出物および抽出残渣に強いアポトーシス誘導能があることがわかった。精製された結晶物は既知ステロイドサポニンであると推測し、構造決定を進めている。
民間薬として用いられている近縁のSalvia属植物についても成分検索を行なっており、その中の1つとしてメキシコ原産植物Salvia leucanthaより新規炭素骨格を有するジテルペノイド化合物(33)を単離・構造決定した。その他、S.fulgens(34-35)、S.splendens(36)などより新規化合物を得た。
- 免疫調整に関与する糖クラスター糸状菌の一種であるケカビよりガラクトース鎖だけから成る化合物(37~40)が報告され、宿主―病原菌の免疫応答に関連する化合物と考え、合成に着手し、現在までに三糖糖脂質38の合成を完了した。

3年目
主に1、2年目に得た新規生理活性物質の生体内ターゲットの特定に関する基礎検討を始めた。引き続き新規生理活性物質の設計と合成、天然物からの探索も行っている。
- がん細胞増殖抑制効果を有するカチオン性フラーレン誘導体による細胞死機構
フラーレン誘導体によるHL-60の細胞死が、アポトーシスであるかネクローシスであるかを検討するため、DNA fragmentationの検出およびAnnexin V-FITC/PI二重染色法によるアポトーシスの評価を行った。いずれの場合もフラーレン誘導体によるアポトーシス誘導は見られず、この細胞死はネクローシスであることが示唆された。また、細胞膜透過性広域カスパーゼ阻害剤z-VAD-FMKもフラーレン誘導体による細胞死に対して効果は見られなかった。他の細胞系についても検討中である。
- 細胞内レドックス制御活性を有する新規化合物の細胞系への影響
抗酸化活性を有する新規化合物に関し細胞毒性の検討を行ったが、いずれも細胞増殖阻害活性は高くなかった。今後、細胞系を用いた酸化ストレス抑制効果を検討する。
- がん細胞増殖抑制活性を有する化合物
キシャヤスデ由来糖脂質を含む種々の糖脂質のマウスメラノーマB16細胞の増殖に対する影響を調べた結果、Manβ(1-4)[Fucα(1-3)]Glcβ1-Cerが最も強い増殖抑制を示した。また、スルホニウム型フラーレン誘導体のがん細胞増殖抑制効果も検討した。ピリジニウム型誘導体に比べ活性は低かったがHL-60細胞の増殖を抑制した。
- NO産生抑制化合物
カイメンより得られた糖脂質は、その構造中のフコースがD体という珍しい糖鎖構造を持ち、またNO産生抑制活性を有することが報告されたことから本化合物の糖鎖及び2~3の関連誘導体を合成し、構造活性相関について検討し、D-フコースが活性発現に重要であることがわかった。
【特に優れている点】
従来の生理活性化合物とは骨格から異なる化合物が得られた点が優れている。生理活性フラーレン誘導体関しては世界をリードしており、他のクロスリンク剤、糖脂質、エンジオール系抗酸化剤などユニークな化合物も得ており、さらに天然物からはジテルペノイド類を見出した。これらの生理活性も特徴的であり、例えば、エンジオール系抗酸化剤はプロオキシダント効果が低く細胞毒性が低い。
また、新規化合物合成を行う中で新たな合成法の開発も行っており、その中で、糖脂質合成において保護置換基、活性基を工夫することによりターゲット化合物をかなり自由自在に合成することが可能となった。
サブテーマ2のグループとの連携でがん細胞増殖抑制の機構解析やNO産生等への効果の検討も始まっている。
【問題点とその克服方法】
多くの化合物の様々な生理活性に注目しながら検討を進めている点が特徴であるが、焦点が絞られていないことは問題点ともなっている。生理活性アッセイ系の再検討と、それに伴いサブテーマ2のグループとの連携の強化がさらに必要である。
【研究成果の副次的効果(実用化や特許の申請など研究成果の活用の見通しを含む)】
様々な化合物を合成し生理活性を検討していく中で当初予想していなかった生理活性が見出された。例えば、フラーレン誘導体のHIV逆転写酵素阻害活性、HCVのRNAポリメラーゼ阻害活性、糖脂質のNO産生抑制などが挙げられ、これらにも注目していく。特許に関してはフラーレン類で出願を行った。
【今後の研究方針】
新たな化合物の設計と合成に関しては、サブテーマ2のグループとの連携で得られた化合物の細胞系への効果の検討をさらに進め、ターゲットのシグナル分子の特定から得られた結果をふまえ、構造の最適化を行う。
天然物からの有効物質探索に関しては、新たに生薬資源の豊富な中国・四川大学との共同研究によりオウバク、ブシ、トウジン、センシンレンなどの四川省産生薬を材料とする。
【今後、期待される研究成果】
フラーレン等の合成化合物、ならびに天然物から新たな生理活性やシグナル分子をターゲットとする化合物の特定と構造の最適化により、新規難治性疾患治療薬のリード化合物を見出すことが期待される。
【プロジェクトの評価体制(自己評価、外部評価を含む)】
HPでの情報公開や学内中間発表会を始め、国内外での学会で研究成果の発表及び学術雑誌での論文発表を行っている。なお、増野の成果については、その研究成果が、新聞で紹介されるなど、マスコミからも注目された。(日経産業新聞 2006年5月22日;抗酸化活性を有するフラーレン誘導体の安全性に関する研究。讀賣新聞2005年10月5日;フラーレンの医療分野における用途と今後の期待に関する記事の中で、フラーレン誘導体の抗エイズ薬、抗がん薬としての可能性についての紹介。日本済新聞 2004年7月16日;フラーレン誘導体が新しい抗C型肝炎ウィルス薬となる可能性の紹介)
サブテーマ2:細胞シグナル伝達分子と薬物との相互作用の解析
グループリーダー 田村 悦臣
(1)研究プロジェクトの目的・意義及び計画の概要
サブテーマ2では、サブテーマ1で開発した生理活性物質のシグナル分子との相互作用を解析し、有効な物質の特定を行うことを目的としている。平成17年度は、昨年度に続き、各種細胞におけるシグナル分子の解析を行った。小林(分子生理学)は、γ-Tocopherolおよびその誘導体について、転移性の高いヒトメラノーマに対する増殖抑制効果について解析した。笠原、園田(生化学)は、好酸球走化活性を有するケモカインのアレルギ-性炎症における好酸球浸潤の機序を解明するために、ヒト肺線維芽細胞株であるHFL-1からのエオタキシン類などのケモカイン産生を検討した。また、好酸球走化因子エオタキシン産生の機序とその抑制剤、NF-kB阻害剤、グリチルリリン誘導体などの検討を行うこととした。田村(衛生化学)は、神経細胞における神経ステロイドの生合成および代謝に関与する酵素たんぱく質の発現様式および皮膚由来培養細胞における薬物代謝酵素の発現調節に関する解析を試みた。杉本(化学療法学)は、Breast Cancer Resistance Protein(BCRP)遺伝子のアミノ酸置換を伴う9種のSNPについて、SNPによるアミノ酸置換がBCRP蛋白の発現量や薬物排出ポンプとしての機能に及ぼす影響をについて検討した。
(4)研究プロジェクトの進捗状況・研究成果等
【スケジュールに照らした各年度ごとの進捗状況及び達成度】
2-1 細胞増殖に対するγ-Tocopherolの効果
1年目
小林ら(分子生理学講座)は、すでに塗布を目的として親水性Toc誘導体であるγ-tocopheryl-N、N-dimethylglycinate hydrochloride (γ-TDMG) を開発し、紫外線照射によって惹起される炎症や色素沈着を抑制できることを報告した。今年度は、γ-Tocopherol(γ-Toc) ならびにγ-TDMGに着目し、γ-Tocならびにγ-TDMGが、転移性のヒトメラノーマHMV-・、HMV-・に対する増殖抑制効果があるか検討した。その結果、各株化細胞をγ-Tocあるいはγ-TDMGで処理するといずれも有意に細胞増殖が抑制され、その効果はHMV-・が最も感受性が高かった。α-Tocはγ-Tocに比べて抑制効果は低かった。この機序として、DNAの断片化が観察され、caspase-3は未処理の約10倍、caspase-9は約2.5倍と上昇した。さらに、チトクロームcの遊離が観察された。これらの結果は、γ-Tocおよび誘導体から変換されたγ-Tocによってヒトメラノーマ内でアポトーシスが誘導されたことを示している。
2年目
マウスに移植したメラノーマB16の増殖を抑制できるかの検討ならびにその増殖抑制メカニズムについて検討した。C57BL/6及びBalb/c nu/nuにHMV-・細胞を皮下注射し、移植後3日目より各薬剤(5%)1日おきに移植部位に塗布すると2週間後腫瘍の大きさが約50%、重さが約30%減少した。γ-TDMGよりもγ-Toc処理による方が大きさ、重さ共に減少していた。組織切片の観察より、γ-Toc処理により腫瘍組織内の細胞密度に減少が見られ、その周辺部ではTUNEL報からアポトーシス誘導が起っていることが分かった。メラノーマ内への移行性はγ-Toc>α-Tocであった。
3年目(現在まで)
竹鼻ら(分子機能生理学)は、白内障発症の一因にDNA損傷が挙げられ、ラジカル消去剤であるMC-186に水晶体中のDNAに対する傷害抑制効果が見られ、白内障発症予防効果が期待できた。
2-2 好酸球走化因子エオタキシン産生の機序とその抑制物質の検討
1年目
笠原ら (生化学講座)は、ヒト肺線維芽細胞株HFL-1からのエオタキシン類の産生を検討した。エオタキシン-1/CCL11産生には、p38MAPK経路とNF-kBの経路が、一方エオタキシン-3/CCL26には、p38MAPK経路とMEK-ERK経路が寄与していること、すなわち、エオタキシン-1、-3の共通の経路としてp38MAPK経路が関与している。また、エオタキシン-1、-3を産生を抑制する薬剤の開発をめざした。本年度は、多発性骨髄腫に対する治療薬プロテアソーム阻害剤Bortezomibに注目した。実際、エオタキシン-1の産生はALLNとBortezomibによって顕著に抑制を受けたが、エオタキシン-3においては若干の抑制のみであった。エオタキシン-1遺伝子上流には転写因子NFκBの結合部位が存在するが、エオタキシン-3遺伝子上流には存在しないため、と考えられた。エオタキシン-1の産生は、p38MAPK阻害剤とALLNやBortezomibとの併用により、相乗的な阻害が見られた。
2年目
グリチルリチンとその誘導体GL11種のIL-8、エオタキシン-1産生への効果を検討した。 GL誘導体であるHetero-30-OH-GLが、18b-GLよりも低濃度かつ低毒性でIL-8、エオタキシン-1の産生を抑制することが示された。Hetero-30-OH-GLはIL-4のシグナル伝達経路を選択的に阻害することでエオタキシン-1の産生を抑制すること、さらにIL-8、エオタキシン-1 mRNAの分解促進に寄与していると考えられた。
3年目(現在まで)
- TNF-receptor associated factor-6 (TRAF6)欠損MEFを用いた、TNFシグナル機構の解析を進めている。
- 1、2年目で有効であった薬物のマスト細胞での脱顆粒に及ぼす効果の検討を行っている。
- 1、2年目で有効であった薬物のin vivoで有効性の検討―アトピーモデルマウスならびに喘息モデルマウスでの活性測定を行っている。
2-3 神経および皮膚由来細胞におけるシグナル分子と薬物代謝酵素の相互作用の解析
神経ステロイドは脳内で合成されるステロイドで、dehyroepiandrosterone(DHEA)やpregnenolone(PREG)およびその硫酸抱合体が知られている。これらは、抑制性GABAA受容体やNMDA受容体に作用して、その感受性を変化させ、記憶・学習・認知等、精神活動を制御する働きがあることが、近年明らかとなってきている。さらに、うつ病やアルツハイマー病患者の脳内神経ステロイドの量的・質的変化が存在するという報告もある。そこで、田村(衛生化学)は、その合成反応を標的とした新規薬物の開発を目指し、ヒト神経系培養細胞における神経ステロイドの生合成および代謝に関わる遺伝子の発現とその変動要因を解析した。
1年目 神経細胞における神経ステロイドの生成と代謝に関する研究
神経ステロイドはコレステロールから、P450sccによりPREGが、さらに、P45017αによりDHEAが生成する。これらは、それぞれヒドロキシステロイド硫酸転移酵素(HS-ST)により硫酸抱合を受け、細胞外へ排出される。これら神経ステロイドの生合成、代謝、および排出に関わる酵素たんぱく質の遺伝子の発現について、神経細胞NB-1およびグリア細胞GI-1について解析を行った。P450sccの発現は両細胞で見られたが、P45017αの発現は、NG-1細胞では非常に弱かった。さらに、HS-STの発現は、2つのサブタイプのうち、NB-1でDHEA選択的SULT2A1が、GI-1でPREG選択的SULT2B1が発現していた。また、硫酸抱合体の排出に関係すると予想されるトランスポーターであるBCRPの発現はGI-1細胞でのみ検出された.以上のことから、神経系細胞における神経ステロイドの生合成、代謝およびその排出には細胞特異性があり、グリア細胞由来のGI-1細胞において神経ステロイドPREGおよびDHEAの産生、硫酸抱合化、細胞外への排出が起きている可能性が示唆された。
2年目 皮膚の分化における薬物代謝酵素の機能に関する研究
皮膚の分化において異物代謝酵素が重要な機能を有していることが示唆されるが、その詳細について不明な点が多い。そこで、本研究では、温度感受性SV40 large T抗原トランスジェニックラット(Tgラット)から表皮細胞(ケラチノサイト)株を樹立し、ケラチノサイトの分化と異物代謝酵素の発現の相関について解析した。いずれの細胞もケラチノサイトのマーカーであるTGM1、IVL、K14を発現していた。K1の発現がみられなかったことから、未分化な細胞株であると考えられる。これらの細胞株とラット皮膚における異物代謝酵素、トランスポーターについてRT-PCRによる解析の結果を表に示す。
3年目(現在まで)
ヒト神経細胞由来NB-1およびグリア細胞由来GI-1細胞について、神経ステロイド生合成系および代謝・排泄系の酵素タンパク質の遺伝子発現を解析した。その結果、これらの細胞において、コレステロールよりプレグネノロンおよびデヒドロエピアンドロステロンが合成されうること、さらに、神経ステロイドの硫酸抱合を行う硫酸転移酵素遺伝子の発現は、NB-1細胞ではSULT2A1、GI-1細胞ではSULT2B1がドミナントであることが判明した。また、硫酸抱合体を細胞外へ排出するトランスポーターBCRPの発現はGI-1細胞のみで見られた。
2-4 BCRPの新規機能性SNPs
1年目
Breast Cancer Resistance Protein(BCRP)はN末にATP結合領域、C末に6回膜貫通領域を有するATP-binding cassette(ABC)トランスポーターである。BCRPはirinotecanの代謝活性化体であるSN-38やmitoxantrone、topotecan等の抗がん剤をエネルギー依存的に細胞外へ排出する。このためBCRP発現細胞はこれらの抗がん剤に耐性を示す。一方、BCRPは正常組織の胎盤、消化管、腎臓、肝臓、造血幹細胞などにも発現しており、正常組織におけるBCRPの発現および活性の変動は、抗がん剤の効果と副作用発現の個人差の原因となると考えられている。
我々(杉本ら、化学療法学)は、EGF receptor(EGFR)のtyrosine kinese阻害剤であるgefitinib(iressa)がBCRPと相互作用することを見いだした。BCRP遺伝子導入ヒト白血病細胞K562/BCRP細胞の培養液に1μMのgefitinibを添加することにより、K562/BCRP細胞のSN-38感受性は親株K562細胞と同程度になり、耐性の完全な消失がみられた。gefitinibはK562/BCRPのtopotecan取り込みを親株と同レベルまで増大させた。gefitinibはBCRP遺伝子導入マウス白血病P388/BCRP細胞を移植したマウスにおいて、irinotecanの抗腫瘍効果を増強した。以上より、gefitinibはBCRPによるSN-38などの抗がん剤の排出を阻害することにより耐性克服効果を示すと結論された。
gefitinibに高感受性を示すヒト扁平上皮がんA431細胞、およびヒト肺がんPC-9細胞にBCRP遺伝子を導入して作成したA431/BCRPおよびPC-9/BCRPはそれぞれの親株に対してgefitinibに8~10倍の耐性を示した。これにより、BCRPががん細胞のgefitinib耐性の原因となるということが示された。目標はほぼ達成された。
2年目
我々は、1年目の研究で、BCRPがシグナル伝達阻害剤gefitinibの感受性に関与することを示した。近年、薬剤反応性の個体差の原因として、遺伝子一塩基多型(SNP)の関与が注目されており、その解析が広く行われている。2年目の研究では、BCRP遺伝子のアミノ酸置換を伴う9種のSNPについて、SNPによるアミノ酸置換がBCRP蛋白の発現量や薬物排出ポンプとしての機能に及ぼす影響をについて検討した。
その結果、BCRP-T623C(F208S)遺伝子導入細胞では、BCRPタンパクの発現量は非常に低く、また細胞膜上のBCRP発現は認められなかった。T623C(F208S)はATP結合領域内でも特に重要とされるWalker B 領域内のアミノ酸置換をもたらすSNPである。そのために、ATPと結合することができない可能性が考えられる。また、細胞膜上に発現していないことからBCRPの膜移行にはATPとの結合が必須である可能性が考えられる。
今回のT623C(F208S)変異は、全長のBCRP蛋白が発現してもトランスポーターとしての機能を示さないSNPとしては初めての発見である。目標はほぼ達成された。
3年目(現在まで)
我々はこれまでに、Erα陽性乳がん細胞においてestrogenがP-gp、BCRP発現を抑制することを示してきた。今回、種々のシグナル伝達系阻害剤のP-gp発現に及ぼす効果について検討した結果、MEK阻害剤U0126、PD98059がヒト大腸がん細胞の内因性P-gpの発現を抑制することを見出した。MEK阻害剤は内因性のみならず、MDR1遺伝子導入細胞の外因性P-gpの発現も抑制した。一方、EGF、bFGFはP-gp発現を増加させた。いずれの刺激下においてもMDR1 mRNAの発現量には変化はみられなかった。以上の結果より、MAPKシグナル伝達系が翻訳あるいは分解レベルでP-gpの発現を制御しているものと推測される。現在、詳細な分子機構について検討中である。
【特に優れている点】
2-1
塗布を目的として親水性Toc誘導体であるγ-TDMGを開発し、紫外線照射による炎症や色素沈着を抑制できること、また、γ-Tocならびにγ-TDMGに転移性の高いヒトメラノーマHMV-・、HMV-・に対する増殖抑制効果があることを見いだしたことである。
一方、白内障患者のほとんどが高齢者であり、発症を5年遅らすことができれば、30~40%患者を減らすことができると言われていおり、現在の治療法は手術が主流であることを考慮すると、MC-186が予防薬として使用できるようになれば、手術適用者の減少につながる。
2-2
エオタキシン-1,3における産生経路の違いを明らかにし、またエオタキシン産生制御の方法を明らかにしたこと。また、グリチルリチン誘導体から、エオタキシン産生を著明に抑制する誘導体を見いだしたことである。
2-3
新たな神経伝達調節因子として見出された神経ステロイドの代謝経路のひとつである硫酸抱合反応をつかさどる硫酸転移酵素の脳内での発現プロフィールについて明らかとした点、また、神経系培養細胞での神経ステロイドの生合成系遺伝子の発現を明らかとし、今後のあらたなツールとして利用できる可能性を示した点である。
2-4
我々の研究は「薬物排出トランスポーターとシグナル伝達阻害剤の相互作用の解析」を目指して開始されたが、これまでに薬物トランスポーターに関与するシグナル伝達阻害剤として、2つの大きな発見があった。
第1は、BCRPがgefitinibの耐性に関与するということである。この研究は我々のオリジナルであり、その後世界中の多くの研究室で追試され、認められている。
第2は、MEK阻害剤がP-gpの発現を低下させるということであり、これも全くのオリジナルな研究である。この研究は、ABC輸送体タンパク発現の制御を通した抗がん剤の効果増強・耐性克服につながる可能性が考えられる。
【問題点とその克服方法】
2-1
MC-186の現在の適用法は静注であり、予防薬としての使用に困難さがあり、点眼など手軽に使用できる環境が必要で、眼科適用を検討する。
2-2
現在、本サブテーマは、in vitroでの研究結果のみであるので、今後は新たに得られた薬物のin vivoでの検討が必要であり、動物実験を充実させてゆく必要がある。
2-3
脳内で合成される神経ステロイドは組織1gあたり数pgと微量であるため、その定量が困難をきわめてきた。本年度本助成資金により導入された四重極型LC/MS/MS装置を用いることにより微量定量法を確立し克服できると期待される。
2-4
特になし。
【研究成果の副次的効果(実用化や特許の申請など研究成果の活用の見通しを含む)】
2-1
γ-Tocおよびその誘導体塗布はメラノーマをはじめとする皮膚がんの予防・治療塗布剤として有用である可能性が示された。
2-2
エオタキシン-3の産生抑制には、p38MAPK阻害剤単独あるいは、MEK-ERK阻害やSTAT-6阻害を組み合わせることが考えられた。今回の実験結果から、NF-κB阻害剤であるプロテアソーム阻害剤はアレルギー治療法にも有用であることが示された。グリチルリチン誘導体によるアレルギー性サイトカイン産生の新規化合物が見いだされた。
サブグループ-1との共同研究で、キシャヤスデ由来糖脂質を含む種々の糖脂質のマウスメラノーマB16細胞の増殖に対する影響を調べた結果、Manβ(1-4)[Fucα(1-3)]Glcβ1-Cerが最も強い増殖抑制を示すことを明らかとした。
【今後の研究方針】
2-1
γ-Tocおよびその誘導体塗布はメラノーマをはじめとする皮膚がんの予防・治療塗布剤として有用である可能性が示されたが、この研究については、小林が退職となったため終結することとした。竹鼻(分子機能生理学)が白内障発症要因としてのDNA傷害とその抑制というテーマで引き続き参画することとした。特に、MC-186の眼科適用に向けての検討を行うと同時に、動物の疾患モデルを用いた個体レベルでの白内障発症予防効果の検討を行う。
2-2
TRAF6のサイトカインシグナルならびにアポトーシス誘導における役割の解析やアトピー性皮膚炎における痒み制御、喘息モデル動物におけるin vivoでの抗アレルギー薬の検討を行う。また、グリチルリチン誘導体からの新規抗アレルギー誘導体の検討を行う。
2-3
LC/MS/MSを活用した微量定量法を確立し、それにより培養神経細胞での神経ステロイドの生合成および代謝・排泄を解析する。さらに、生合成および代謝に対する様々な中枢神経作用物質(薬物や民間療法)の影響を解析し、中枢作用との相関を解明する。
2-4
我々は、MEK阻害剤がヒト大腸がん細胞のP-gpの発現を抑制することを見出した。今後は、BCRPなどの他のABC輸送体にの発現に対するMEK阻害剤の効果を調べる。また、この分子機構について解析して、MEKの下流に位置して実際にP-gpの発現を制御している分子を同定することを目指す。
【今後、期待される研究成果】
2-1
MC-186のDNA損傷抑制効果は明らかであるので、予防薬の分野を開拓するためにも眼科適用に関する検討を行い、簡便に使用できる環境を作り、本疾病の減少につなげたい。
2-2
TNFαを介するサイトカインシステムの新たな機構の解明が期待されるとともに、新規の抗アレルギー薬の開発が期待される。
2-3
神経ステロイドの生合成および代謝・排出に影響を与える化合物を見出し、新たな中枢神経作用薬のシードを見出すことが期待される。
【プロジェクトの評価体制(自己評価、外部評価を含む)】
各研究グループが関連学会(日本生化学会、薬学会、免疫学会、がん学会など)で発表、成果を報告するとともに、英文原著論文として報告する。
サブテーマ3:シグナル伝達制御を基盤とした薬物療法の最適化研究
グループリーダー 中島 恵美
(1)研究プロジェクトの目的・意義及び計画の概要
【目的・意義】
難治性疾患治療薬の開発においては、ターゲットとして有用と思われる細胞内シグナル分子とその制御因子の機能解明、適切な病態モデルを用いたアプローチ、病態マーカーの開発、薬剤の有効性と安全性の評価のためには高感度且つ選択的なアッセイシステムの構築、組織関門を介した薬物透過機構解明、標的部位への薬物送達や放出制御、両親媒性の機能性高分子応用したDrug Delivery System (DDS)によるパッシブターゲティング、標的部位において物理化学的刺激に応答した薬物放出制御法の確立など様々な課題を解決することが必要である。そこでサブテーマ3では、候補化合物を治療薬として実用化に向けてin vitroおよびin vivoの評価系の開発と薬物療法の最適化研究を目的としている。
【計画の概要】
サブテーマ3に参加する研究者らは、これまで、独自に開発したAChの超高感度(1 pg/tube)ラジオイムノアッセイ(RIA)を用いた哺乳類のリンパ球や血管内皮細胞などの非神経性組織におけるACh発現の証明、脈管・関門組織モデル細胞株の樹立、環境変化を認識し応答する機能性高分子の分子設計、外部刺激により標的分子との相互作用を制御可能な生体機能解析システムの検討、細胞内シグナル分子を標的とした難治性疾患に対する新規治療薬のin vivoモデルからのアプローチなどを行なってきた。
本プロジェクトにおいては、T細胞におけるコリン作動系の役割およびリンパ球細胞内シグナル伝達機構の解明、脈管・組織関門機能維持機構におけるシグナル伝達の役割と薬物輸送機能の解明、新たな炎症マーカーの開発、シグナル伝達調節因子の標的化・安定化のための薬物送達システム構築、末期腎不全に陥る原因疾患として現在一番多い糖尿病性腎症の初期病変に対する有効な治療法を確立するためのdb/dbマウスを用いた微量アルブミン尿の発症機序の検討等を行っている。
(4)研究プロジェクトの進捗状況・研究成果等
【スケジュールに照らした各年度ごとの進捗状況及び達成度】
3-1 非神経性アセチルコリンによるリンパ球機能調節メカニズム
1年目
川島ら(薬理学講座)は、卵白アルブミン (OVA) を提示している抗原提示細胞とT細胞との接触により、Tリンパ球コリン作動系が活性化されることを明らかとした。また、免疫亢進モデル動物MRL-lprマウスにおいてリンパ球コリン作動系が活性化されている可能性、シンバスタチンが、コレステロール産生機構とは別に、Tリンパ球におけるコリン作動系の活性化に寄与している可能性、免疫抑制作用の一部にリンパ球コリン作動系活性の調節機構が関与している可能性を示唆した。
2年目
In vivoにおいてT細胞がAChを合成することを証明するとともに、合成されたAChがその後の免疫系に対してどのように作用するかを明らかとするため、MitogenによるT細胞のChAT遺伝子の発現誘導が、抗原提示により惹起されるか否か解析を行った。OVAに対して反応性の高いT-Cell Receptorを発現するCD4陽性T細胞を有するマウス(DO11.10)より調製したCD4陽性T細胞を、syngenicマウス由来のbone marrow derived dendritic cell(BMDC)とOVAにより刺激を行い、CD4陽性T細胞でのChAT遺伝子発現、ACh遊離の上昇に関して解析を行った結果、AChの遊離量の増加を確認した。また、同実験系において、mAChRもしくはnAChRの阻害剤を用い、抗原提示におけるT細胞の細胞増殖へのAChの影響について解析した処、増殖への効果は確認されなかった。
3年目(現在まで)
T細胞の分化への影響について引き続き解析を行っている。最近、抗原提示細胞であるマクロファージ上のnAChR(α7)をニコチンにより刺激すると、LPS刺激に伴う炎症性サイトカイン、TNF-aの放出が抑制されることが報告された。また、α7には内因性のアロステリックリガンドとして、SLURP-1分子が同定されている。現段階で、α7を介した、抗炎症作用の分子メカニズムは明らかとなっておらず、その解明は新しい敗血症治療法の開発に繋がると考えられる。そこで、我々はSLURP-1の生理的役割とその分子機序を明らかとすべく、現在SLURP-1タンパクの精製を行っている。
3-2 血管新生と脈管・組織関門維持におけるシグナル伝達と薬物輸送機能解明
1年目
中島ら(薬剤学講座)は、TR-BME細胞が陽性骨髄由来血管内皮前駆細胞であり、bFGF刺激により自己増殖し前駆細胞の機能を維持すること、VEGF刺激により血管構造を形成すること、血管内皮細胞および血管壁細胞のマーカー遺伝子を発現し、bFGF刺激を除くと収縮型血管壁細胞に分化すること、PDGF-BB刺激により増殖能を持つ合成型血管壁細胞に可逆的に形質変換することなどを明らかにした。また、TR-PCT等血液脳関門細胞におけるABCG2の発現と細胞内局在を明らかにした。
2年目
ラット胎盤および胎盤関門モデル細胞株TR-TBT細胞におけるezrinの発現と細胞内局在性を明らかにした。また、TR-TBT細胞を用いて甲状腺ホルモン[125I]T3および[125I]T4の取り込みに、それぞれ低親和性および高親和性のトランスポーターが関与することを明らかにした。さらに[3H]uridine取り込みが基質濃度に対して飽和性、Na+非依存性で主にENT1およびENT2を介して輸送されることを示唆した。
3年目(現在まで)
胎盤関門機能維持機構におけるezrinの役割の解明を目的としてezrin欠損マウスを用いた解析を行っている。またTR-TBT細胞を用いて、hypoxanthineやヌクレオシド類似構造を持つ薬物の胎盤関門輸送機構の解明とトランスポーターを介した薬物相互作用に関する研究を行なっている。
3-3 酸化ストレス応答性蛋白の発現解析と薬物療法モニタリング
1年目
生体分析化学講座では、新たな炎症マーカーとしてアンチキモトリプシンを選択し、アンチキモトリプシン結合糖鎖(10種類)をELISA法を用いて簡便に測定できる方法を開発した。
2年目
アンチキモトリプシン結合糖鎖構造解析を行い、これまで報告されていない位置にN型糖鎖の結合を見いだし、その構造を、MSを用いて推定した。
3年目(現在まで)
アンチキモトリプシンに5つある糖鎖結合サイトのうち4つまで糖鎖の結合を確認し、その構造解析を行っている。計画通り、本年度中には、アンチキモトリプシンの構造解析を終了する予定である。
3-4-1 細胞内シグナル解析のための新規アッセイシステムの開発
1年目
金澤ら(創薬物理化学講座)は、温度応答性高分子の側鎖にプロトンセンサーとしてイオン解離基を導入することにより温度やpHに応答する高分子を設計し、これを利用し外部刺激により目的試料との相互作用を自由に制御する分離システムを確立した。
2年目
環境変化を自ら認識し応答する機能性高分子を分子設計し、生体機能解析システムに応用することにより、外部刺激により標的分子との相互作用を制御するアッセイシステムについて検討している。これによりリン酸化チロシン及びチロシンキナーゼの基質ペプチドのリン酸化の検出に成功した。
3年目(現在まで)
生体機能解析システム構築のために、キャピラリーLCやマイクロチップによる生体内微量成分の分離、ハンディ型表面プラズモン共鳴センサー(SPR)を用いた検出について検討している。
3-4-2 機能性高分子を用いた新しい薬物送達システムと遺伝子導入法への応用
1年目
新たに無機化合物を用いたナノ微粒子製剤を開発し評価を行った。その結果、100nm以下の粒子径を有し、分散安定性が高く、シクロスポリンを高率で封入可能なナノ微粒子が調製可能となった。DDS学会、薬学会、ライフサポート学会で報告した。
2年目
機能性ポリマーを薬物送達システムDDSに応用することにより、パッシブターゲティング機能に加えて、標的部位において物理化学的刺激に応答した薬物放出制御が可能となる。機能性高分子poly(NIPAAm)共重合体を安定化剤として導入した温度応答性リポソームを作製した。導入高分子の相転移温度に基づき、内封薬物の温度による効果的な放出と高い放出率が得られた。
3年目(現在まで)
遺伝子導入法の検討のためカチオン性高分子を合成し、pDNA(pCMV-LacZ)との複合体を形成させ、温度の影響を検討した。その結果、温度により複合体の形成量に差が見られた。また、CACO-2細胞へのトランスフェクションによりβ-ガラクトシダーゼの発現が見られ、温度制御により遺伝子導入をコントロールするという新しい方法の可能性が示唆された。
3-5 糖尿病性腎症のシグナル伝達制御
1年目
薬物治療学講座では、インスリン抵抗性モデル動物での遺伝子発現をDNAアレーにより評価する予定に対し、蛋白尿モデル動物を用いて蛋白尿発症マーカーであるネフリンに対して、RNA発現、タンパク発現を評価する系を確立した。
2年目
インスリン抵抗性モデル動物での遺伝子発現をプロテオミクスにより評価する予定に対し、インスリン抵抗性モデル動物としてdb/dbマウスを用い、ネフリンのほか各種腎機能の糖尿病発症に伴う変化を検討した。
3年目(現在まで)
現有の各種糖尿病治療薬の効果をDNAアレーあるいはプロテオミクスを用いて評価する予定に対し、腎臓でのレプチン受容体変異と糖尿病発症の関連を検討中である。
【特に優れている点】
3-1
アセチルコリンが免疫系の制御物質として機能しているという概念を世界に先駆けて提唱し、この方面の研究の潮流を作った。
3-2
薬剤学講座で独自に樹立し、従来の細胞株よりも優れた特質を持つモデル細胞株(TR-BME, TR-TBT, TR-PCTなど)を用いることで、オリジナリティーの高い研究が可能である。
3-3
臨床応用可能なELISA法を用いて、タンパク質の寿命、シグナル伝達、活性制御につい関与する糖鎖の網羅的を測定可能としたこと。
3-4
環境応答性高分子を用いた本システムは創薬ターゲットとなるリン酸化ペプチドの選択的な新規分離法として期待される。機能性高分子をリポソームあるいはDDSの担体に修飾することにより、標的部位において物理化学的刺激に応答した薬物放出制御が可能となる。
3-5
ヒトの糖尿病性腎症にもっとも近いモデルと言われているdb/dbマウスを用いていること。
【問題点とその克服方法】
3-1
アセチルコリンの免疫調節機構としては、免疫反応時に起こる急性作用と、個体の免疫反応維持に関わる慢性作用(長期作用)が考えられる。急性作用については培養細胞系などを用いた詳細な検討が可能であるが、慢性作用については動物を用いた長期投与実験を行う必要がある。現在、免疫方法等の最適条件の検討を行っている。
3-2
胎盤関門機能のin vivoにおける実証が今後の重要な課題となる。これについてはezrin欠損マウスなどを入手し既に解析を始めている。欠損マウス維持は本プロジェクトにより整備された飼育施設を利用することで可能となっている。
3-3
本研究では、炎症の病態(初期、極期、回復期)を外来で分析可能とすることを目的としている。現在分析対象としている血清では、短時間での検査ができないため、尿など簡単に採取可能な試料を用いる必要がある。このため、新たにイムノクロマト法による分析法を検討する。
3-4
選択的な薬理効果の向上ためには、高度な制御システムと適切な薬物放出制御機構を備えた多様な機能を有する担体(キャリアー)の開発が必須である。刺激応答性あるいは抗原抗体反応を感知するような機能性高分子を用いてRES回避性、血中滞留性、標的部位への定着性の向上を図り、さらに刺激応答性の薬物放出制御機構も備えた新規薬物送達システムの開発を目指す。
3-5
db/dbマウスの対照として、wild typeを用いると、レプチン受容体変異以外に高血糖、肥満などの交絡因子が問題となる。ob/obマウスを用いることにより、これらの交絡因子は除去可能である。
【研究成果の副次的効果(実用化や特許の申請など研究成果の活用の見通しを含む)】
3-1
敗血症などの急性炎症時にもリンパ球コリン作動系が関与するとの知見が蓄積しつつある。
3-2
骨髄由来血管内皮細胞前駆細胞が、血管内皮細胞と血管壁細胞をターゲットとした新たな治療法の開発に利用できる可能性が示されている。
3-3
O-結合型およびN-結合型糖鎖の網羅的解析法の開発につながる可能性がある。
3-4
これまで複数の特許取得および分離カラムの実用化の経験を踏まえ、新規アッセイシステムや薬物送達システムについても特許申請および実用化を目指して研究を進めていく。
3-5
糖尿病性腎症の発症原因として高血糖以外の要因が見つかる可能性がある。
【今後の研究方針】
3-1
アセチルコリンの免疫制御機構を解明することで、新規免疫制御薬剤の開発を目指す。
3-2
TR-BME細胞の抗がん薬に対する感受性を種々がん細胞と比較する。胎盤関門を中心に種々薬物の輸送機構と薬物相互作用の解明、胎児への影響を検討する。
3-3
次年度以降、臨床医との共同研究を開始し、開発した本法の有用性について検討するとともに、培養細胞をもちいて、病態により結合している糖鎖構造が変化するメカニズムを解析する。
3-4
環境応答型マイクロ分離技術とSPRによる検出を組合せることにより細胞内シグナル解析のための新しいアッセイ法の構築を目指す。標的部位に集積し、刺激応答性の薬物放出制御が可能なDDSを検討する。
3-5
レプチン受容体とそのシグナル伝達と、糖尿病性腎症発症の関連について検討を進める。
【今後、期待される研究成果】
3-1
リンパ球コリン作動系をターゲットとする新たな免疫制御薬剤の開発
3-2
TR-BME細胞の血管新生阻害を持つ抗がん薬スクリーニング系への応用およびTR-TBT細胞の薬物の胎盤透過性や胎児毒性の評価系としての応用
3-3
本法の有用性が確認できれば、炎症の病態(初期、極期、回復期の判別)が外来で判断でき、患者への抗炎症薬等の投与量設定に十分貢献できる。
3-4
リン酸化ペプチドなどのシグナル伝達系の選択的な新規分離法の構築および環境応答型の効果的なDDS製剤及び温度制御型の新規遺伝子導入法の構築
3-5
腎臓におけるレプチン受容体局在と機能異常の解明およびレプチン受容体シグナルに影響を与える薬物による糖尿病性腎症治療の可能性
【プロジェクトの評価体制(自己評価、外部評価を含む)】
HPでの情報公開や学内中間発表会を始め、国内外での学会で研究成果の発表及び学術雑誌での論文発表を行っている。
研究進捗概要
(1)研究プロジェクトの目的・意義及び計画の概要(プロジェクト全体)
本研究は、細胞内シグナル分子や転写因子と薬物との相互作用を明らかにするとともに、シグナル分子を標的とした難治性の疾患に対するより優れた治療薬の開発をめざして、全学的なプロジェクトチームを組み、研究を展開するものである。本学では、従来の医薬品とは異なるユニークな生理活性化合物を合成・探索しており、また、シグナル分子に関する先端的な研究活動を行っている。そこで、新たなシグナル分子を標的とする難治性の疾患治療薬開発が可能であると考えた。3つのサブテーマに絞って、本プロジェクトを計画し、平成18年度は、3年目となる。サブテーマ1で開発した生理活性物質のシグナル分子との相互作用をサブテーマ2で解析し、有効な物質の特定を行う。サブテーマ3では、選択された化合物を治療薬とするための最適化を図る。笠原が全体のプロジェクトを総括し、3つのサブテーマ間を調整し、協力体制を整える。
(2)研究組織
本プロジェクトを計画遂行のために、以下の3つのサブテーマに絞り、それぞれグループリーダーを決めた。
サブテーマ1:シグナル分子を標的とする疾患治療薬の設計と開発 (グループリーダー増野)
サブテーマ2:細胞内シグナル伝達に関わる分子と薬物との相互作用の解析 (グループリーダー田村)
サブテーマ3:シグナル伝達制御を基盤とした薬物療法の最適化研究 (グループリーダー中島)
本プロジェクトでは、サブテーマ1で開発した生理活性物質のシグナル分子との相互作用をサブテーマ2で解析し、有効な物質の特定を行う。サブテーマ3では、選択された化合物を治療薬とするための最適化を図る。研究代表者の笠原が全体のプロジェクトを総括し、3つのサブテーマ間を調整し、協力体制を整える。
なお、生体防御薬学研究センターが研究機器の管理運営に当たり、研究をサポートする。
(3)研究設備等
本学においては、動物飼育施設が不十分であり、その拡充を計るため、平成16年度の私立大学施設整備補助金で、既存の施設を動物飼育室として転用、増築を図った。また、平成17年度は研究装置として、「細胞内シグナル伝達に関わる分子の高感度測定システム」として、LS-MS/MS、イメージングアナリシスシステムなどを整備した。これにより、学内で創製される新たな薬剤の細胞レベルからモデル動物での有効性、安全性の評価まで、一貫した研究体制を整えることが可能になった。
(4)研究成果発表会と概要の報告
本研究プロジェクトの第一回中間発表会を平成17年9月9日(金)に、また、第二回中間発表会を平成18年9月8日(金)に本学にて開催した。本プロジェクトの活動内容についての中間報告書は平成19年3月にまとめ、刊行した。
公開シンポジウム
生体防御薬学研究センター第5回公開シンポジウム
- 日時:
- 平成20年9月5日(金)13:10~18:00
- 場所:
- 慶應義塾大学薬学部・芝共立キャンパス 1号館地下1階マルチメディア講堂


