元素のちからを活用する、化学薬学研究
薬化学講座では、新しい薬をつくる有機化学と、よい方法でつくる有機合成化学に加え、それらの化学の根底に眠る「元素」「結合」「分子」および、それらが織りなす反応の原理・原則を明らかにするべく、基礎から応用まで幅広い内容を対象に研究に取り組んでいます。新しい薬のもととなる、未知の分子骨格や官能基を合成するためには、新たな反応や方法論が必須となります。そのため、反応や現象が "なぜ"、"どのように" 起こるかを分子レベルで理解することはきわめて重要と考えており、これを明らかにすることを大切な研究課題と位置づけています。これまで利用されていない「エネルギー源」と「分子」との関わりを通じて、新しい概念を見出し、それにより、独自の方法論を創出する研究にも取り組んでいます。
また、新しい薬をつくる有機化学では、新反応・新試薬の開発のみならず、薬を創り出すために、その物質を受けとめる酵素・受容体などの生体分子の働きを知ることが大切です。そこで、それらの機能の解明に役立つ、生体機能性分子の新規合成法や新規修飾法の開発を通じ、生命現象の理解、医療に貢献する研究にも積極的に取り組んでいます。
上記研究すべてに共通する大きな目標は、「分子」の特性を深く理解し、それらが支配する「反応」の真理を明らかにし、それらを活用して、新しい化学を切り拓いていくことです。
これまでの研究
周期律表で、希ガスを除くと右端の第 17 族に位置するハロゲンは、同周期で最も電気陰性な元素群であり、電子を一つ受け取ると希ガスと等電子構造のハロゲン陰イオンとなり、大きく安定化されます。この傾向のため、逆に孤立電子対を相手に奪われることは嫌がり、通常、有機化合物に含まれるハロゲンは共有結合を一本持つ一価の状態で化学的に安定に存在します。
しかし、最も原子番号の大きなヨウ素は、強い酸化剤や求電子剤を用いて "無理やり" 電子を奪うことにより原子価を拡張して三価や五価の超原子価状態を形成することができます。この超原子価状態のヨウ素は潜在的に高いエネルギーを持ち、もとの一価の状態へ還元されることを推進力として、通常では進行しない反応を起こすことが知られています。例えば、教科書では進行しないと説明されているビニル位炭素上での二分子求核置換(SN2)反応は、超原子価ヨウ素置換基を持つ化合物 1 を用いると、室温で容易に進行します。このとき超原子価ヨウ素置換基(ハイライトした部分)が脱離していますが、これはこの置換基がきわめて高い脱離能を示すためで、数値にするとその脱離能は、スーパー脱離基 TfO 基のおよそ百万倍にものぼります(私たちは、この脱離基を超脱離基と呼んでいます)。
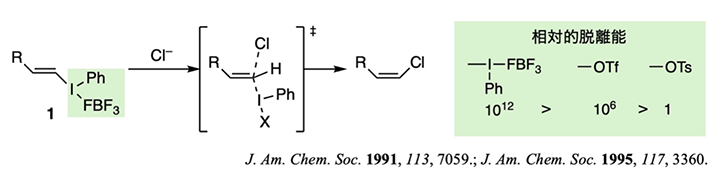
最近では、より強力な武器として、周期表で上に位置する超原子価臭素や塩素化合物も合成できるようになりました。これらのより電気陰性な元素の場合、超原子価状態は一層高エネルギーになるため、その脱離能は、臭素ではヨウ素の場合の百万倍、塩素では更にその数百倍にも到達します。
この超脱離基の卓越した反応性を利用することで、いままで有機化学で知られていなかった、未知の反応や中間体を見出すことが可能になるかもしれない、ひいては化学の教科書の1ページに新しい原理原則を追加できるかもしれない、と夢見てこれまで研究を行ってきました。
以下に、幸運にも恵まれて見出すことができた化学種の一つ C2 について簡単に紹介します。二原子炭素(C2)は炭素二つから構成される地球上において最も単純な炭素分子です。古くから、ろうそくの青い炎や宇宙空間に存在することが知られてきましたが、発見から一世紀が過ぎた現在でも、その基本的性質さえ謎に包まれています。これまで、C2 は過酷な条件(たとえば、3500 度以上にした炭素蒸気)でしか発生しないと考えられてきたため、高エネルギー状態での発生・調査・研究が行われてきました。黒鉛へのアーク放電やレーザー光照射などにより C2 を人工的に発生させることができますが、こうして発生させた C2 は、「二重結合(一重項ジカルベン)」か「三重結合(三重項ビラジカル)」として振舞うと実験化学によって結論づけられてきました(図1)。ところが、2012 年にイスラエルのグループらは高精度量子化学計算を用いて「C2 は基底状態において "四重結合(一重項ビラジカル)性" をもつ」と提唱しました。すなわち、実験化学者と理論化学者の見解は真っ向から対立し、大きな議論へと発展していました。
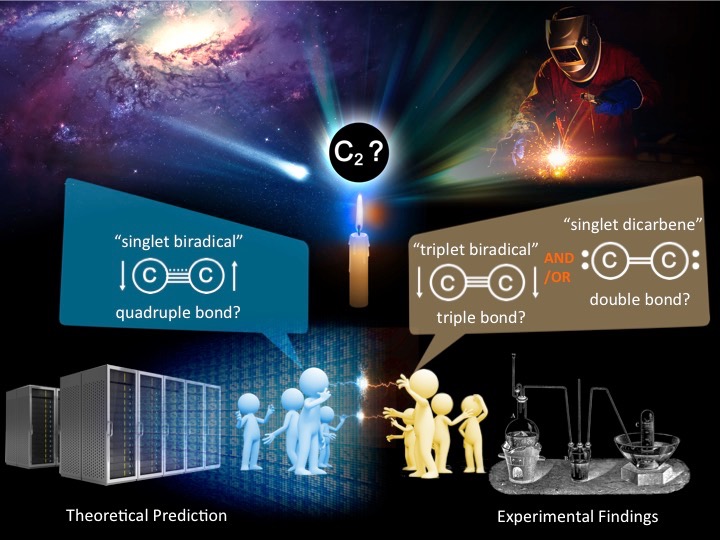
私たちは、C2 における解釈の大きな乖離は、実験条件と理論条件の違いによるものではないかと考えました。すなわち、理論条件では基底状態(安定状態)での C2 の性質を議論しているのに対して、実験化学による C2 の発生には高エネルギーが必要であったため、励起状態(不安定な状態)での性質を観測してきたのではないかと考えたところに今回の研究のスタートラインがあります。
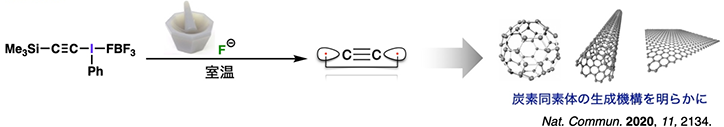
そこで本研究では、室温(あるいはそれ以下)での C2 の発生に取り組みました。私たちは、超原子価ヨウ素化合物の超脱離能は、C2 を化学合成する鍵となるかも知れないと考えました。早速、超原子価ヨウ素置換基とケイ素官能基(TMS 基)で C2 ユニットを挟んだ分子 (2) をデザインし、このものにフッ化物イオンを作用させると、室温以下でもアセチレン(HC≡CH)の発生が確認されました。本反応は、極めて安定な「ケイ素−フッ素結合」をつくる原動力によって中間体 A が一旦生成した後、超原子価ヨウ素の脱離によって C2 が速やかに発生し、その後溶媒(CH2Cl2)などから水素を獲得し、アセチレンが生じたと考えられます(図2a)。こうして発生させた C2 の性質を、実験化学を用いて丁寧に調べたところ、高エネルギー条件下において生じた C2 とは全く異なる挙動を示すことが明らかとなってきました。たとえば、高エネルギーにて発生させた C2 を捕捉することが報告されているシクロオクタテトラエンや、アセトフェノン、シクロオクタンを反応に用いても、今回合成した C2 は全く捕捉されませんでした。つまり、常温常圧にて発生させた C2 は「ジカルベン(二重結合)」や「三重項ビラジカル(三重結合)」の性質は全く示さなかったのです。
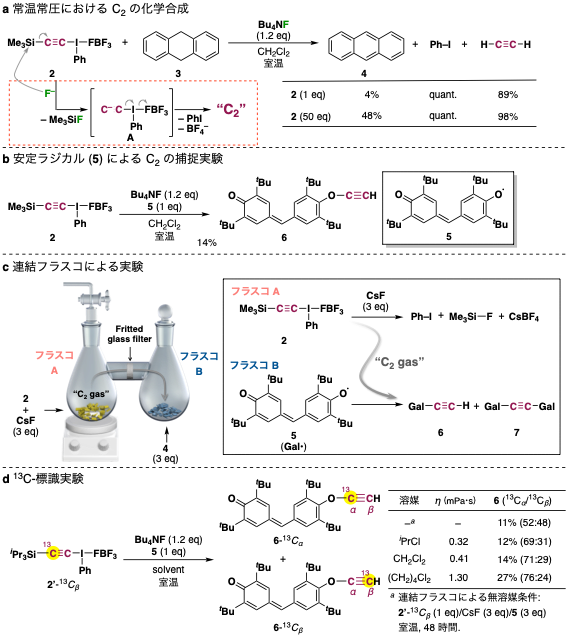
C2 が(理論予測通りに)電荷シフト結合を有しているとすると、ラジカルとしては比較的安定な一重項ビラジカルに近い性質を示すはずです。そこで、安定ラジカルでも反応可能な 9,10-ジヒドロアントラセン (3) や ガルビノキシルラジカル (5) を系中に加えてみたところ、期待通りアントラセン (4) とアセチレン、エチニルエーテル (6) をそれぞれ生成物として与えました(図2a, b)。次に、デザインした連結フラスコを用いて、フラスコAにて発生させた C2 をフラスコBにて無溶媒条件下にて 5 と反応させたところ、主生成物の 5 に加えて、C2 の両端に 5 が付加した 7 も得られました(図2c)。さらに、13C で片側の炭素を標識した分子 (2'-13Cβ) を設計・合成し、5 との反応に用いたところ、溶媒の有無や粘性によって選択性は変化するものの、C2 の両側から反応したと考えられる混合物 (6-13Cα / 6-13Cβ) が得られました(図2d)。これらの結果を整理すると、常温常圧下、化学合成した C2 は「比較的安定な気体分子として振る舞うこと」「電荷シフト結合(一重項ビラジカル)を含む4つの結合を有すること」など、理論化学者の予測を強く支持するものでした。こうして、実験化学者との長年の論争に決着をつけることができました(Nat. Commun. 2020, 11, 2134)。
ところで、皆さんは、この C2 からサッカーボール状の炭素同素体:フラーレン(図3)が生じるというと、信じられるでしょうか?実際、C2 を固体状態で重合させると、様々な炭素同素体(無定形炭素、グラファイトなど)といっしょに、フラーレンや筒状シート構造を持つカーボンナノチューブが生成することがわかってきました。これらの化学種がどうやって生成しているか、その反応機構について多くの科学者が興味をもって研究をおこなってきましたが、未だに正確な機構は謎に包まれています。しかし、C2 がその起源の一つであることは確かであることは、今回わかりました。近い将来、新しい理論が構築されることが楽しみです。
このように、有機化学の実験室のフラスコ内で容易に未知の化学種を化学合成できるようになることによって、謎に包まれた性質が明らかになり、新しい理論の礎となり、思いもしなかった応用(ナノカーボン合成(材料科学)、星間物質発見(天文学/地学)、生命誕生の謎の解明(生物科学)など)が期待されるなど、多くの学際領域への波及効果が期待されます。今後も、継続して元素のちからを活用して、新しい反応、中間体、理論を切り拓いていきたいと考えて研究を行っています。


